寻找血液肿瘤 Biomarker 还能怎么做?试试信号通路!
01 背景
血液肿瘤中的 B 细胞淋巴瘤发病机制复杂,但临床治疗方案及预后评估的 Biomarker 仍然匮乏[1-5]。现有基于液态活检的 NGS 方法多从基因组变异的角度来寻找。近期,在一项 B 细胞淋巴瘤患者预后效果研究中,作者在常规体细胞变异分析基础上,创新性地从多基因突变与信号通路关系角度出发,发现了 SEPT6_TRIM33 基因融合和 TP53 信号通路的重要作用,为预后分层和潜在治疗靶点提供了新型 Biomarker。这一新颖的思路和角度,值得我们深思,低头赶路时也要记得抬头看看方向。
这项由福建中医药大学第三附属医院血液科联合福建医科大学协和医院共同展开的研究成果“SEPT6_TRIM33
Gene Fusion and Mutated TP53 Pathway Associate With Unfavorable Patients With
B-Cell Lymp Prognosis in Patients With B-Cell Lymphomas”发表在期刊 Frontiers in Oncology (IF = 5.738)。该研究收集了 79 名 B 细胞淋巴瘤患者的 cfDNA 样本,对 560 个肿瘤基因捕获测序后,系统分析了体细胞突变、基因融合事件和信号通路组成基因,以及其对治疗反应和预后的相关性。这项研究为 B 细胞淋巴瘤患者提供了潜在的药物靶点,有助于提升患者生存率。
值得注意的是,该研究中使用的文库构建及杂交捕获方案均基于纳昂达推出的系列产品。
02 研究方法
• 外周血 cfDNA 样本:
2017 年 12 月至 2021 年 4 月在福建医科大学附属协和医院诊断为 B 细胞淋巴瘤的 79 例患者,从每例患者抽取外周血 (10 mL) 用于 cfDNA 分析。
• 文库构建及靶向捕获测序:
采用 NadPrep®️ DNA 通用型文库构建试剂盒 (for Illumina®) 构建 DNA 预文库,以定制 Panel (560 个癌症相关基因) 搭配液相杂交捕获试剂进行靶向捕获并测序。
• 数据分析:
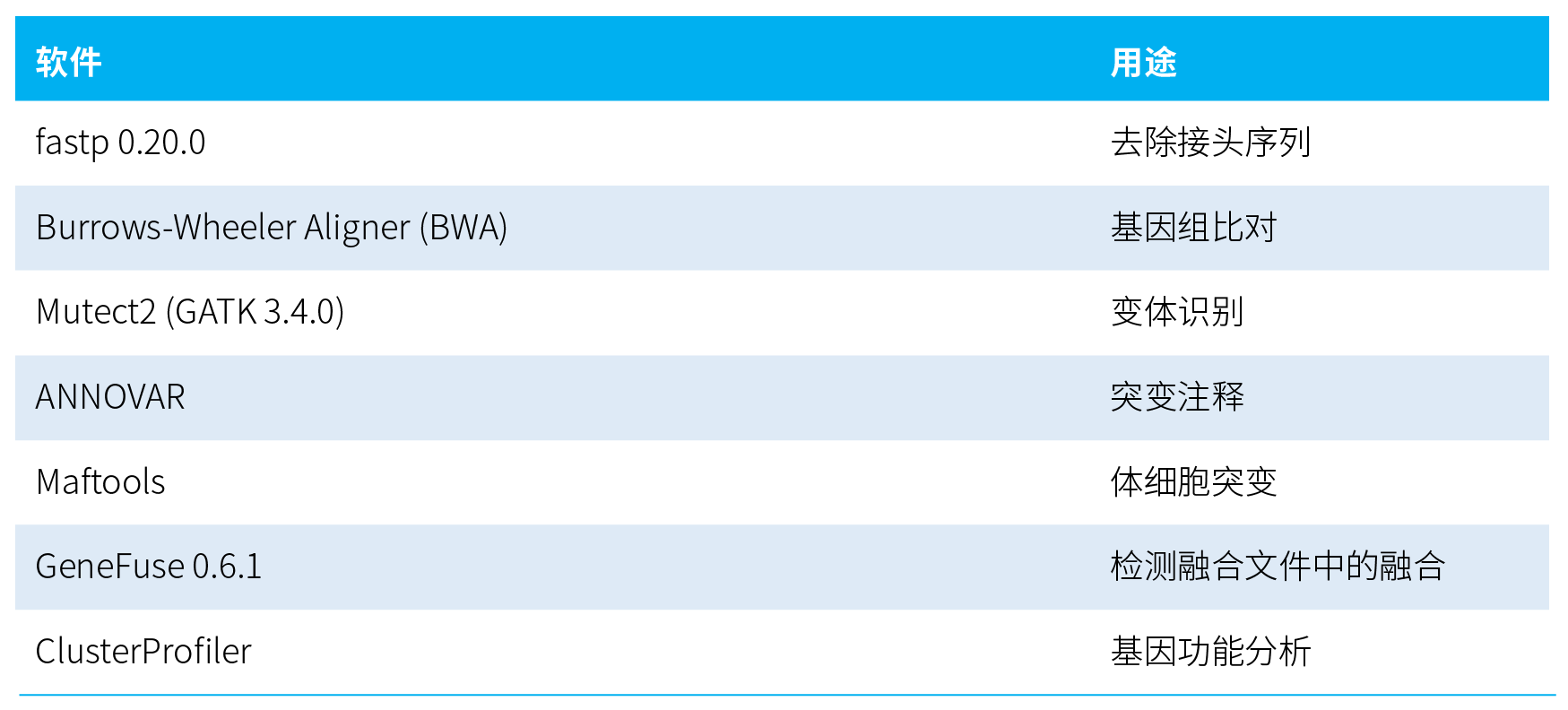
03 结果
3.1 B 细胞淋巴瘤患者的基因组变异
为了全面了解 B 细胞淋巴瘤患者的基因组变异,基于靶向测序对 79 例 B 细胞淋巴瘤患者的体细胞突变和基因融合事件进行了鉴定,共鉴定出 666 个突变,其中主要突变类型包括错义突变 (79.0%)、无义突变 (10.4%)、移码缺失突变 (5.1%)、非移码缺失突变 (2.5%)、移码插入突变 (2.4%) 和终止密码子突变 (0.6%)。此外,从 560 个与癌症相关的基因中检测到了 262 个基因的突变,在 59 例患者中发现了这些突变基因。
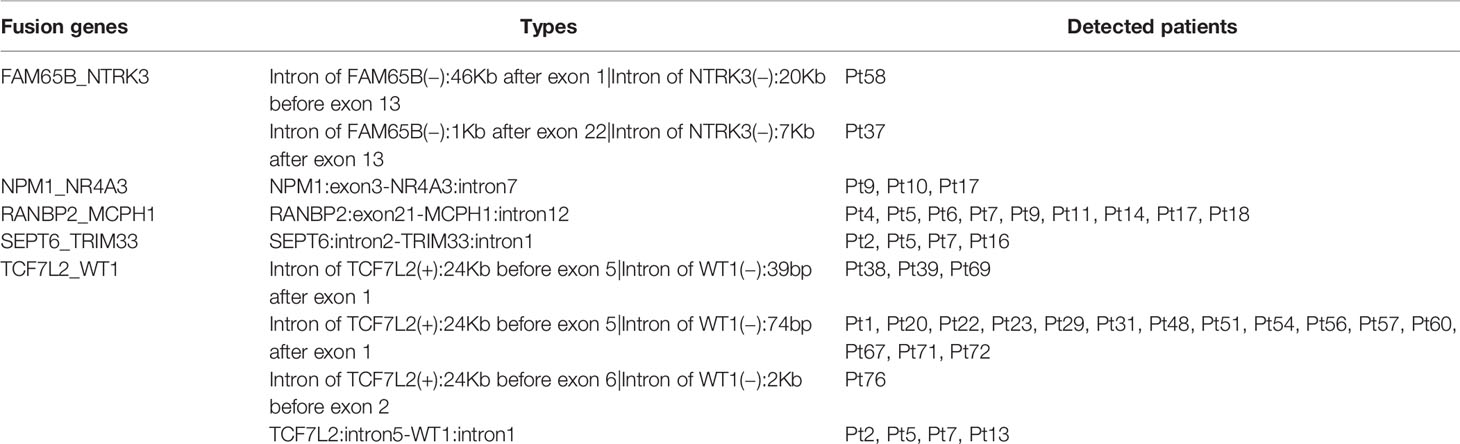
基因融合是血液系统恶性肿瘤中一类重要的体细胞突变[6]。因此,研究分析了队列中的基因融合事件,发现至少有 2 例中检测到 5 个融合基因,包括:FAM65B_NTRK3、NPM1_NR4A3、RANBP2_MCPH1、SEPT6_TRIM33 和 TCF7L2_WT1。其中,有 4 名患者携带了 SEPT6_TRIM33 基因融合,而 9 名患者则携带了 RANBP2_MCPH1 基因融合。值得注意的是,TCF7L2_WT1 基因融合在 29.1% 的患者中 (23/79) 最常被检测到 (表 1.)。
表 1. 从 79 例 B 细胞淋巴瘤患者中鉴定出的融合基因
3.2 7 种典型致癌信号通路的突变
为了确定在 B 细胞淋巴瘤中优先突变的通路,研究评估了 7 种典型致癌通路基因的突变事件。这些通路的突变图谱如图 1.所示。TP53 突变谱主要以 TP53 突变为特征,而 CDKN2A、CCND3、FAT1、CREBBP 和 PTEN 分别是细胞周期、Hippo、NOTCH 和 PI3K 突变谱中最常见的突变基因。值得注意的是,在研究队列中,TP53 和 NOTCH 通路均是 B 细胞淋巴瘤中最常见的突变致癌通路。近 1/5 的患者携带了在这 2 种通路中至少 1 个组成基因的突变 (19/79)。此外,研究发现 79 例患者中分别有 7 例 (8.86%)、6 例 (7.59%) 和 6 例 (7.5%) 分别携带了 Hippo、WNT 和细胞周期通路基因的突变 (图 2.)。另外,有 19 例患者同时携带了至少 2 种通路的基因突变,而 21 例患者仅携带了 1 种突变通路的基因突变。
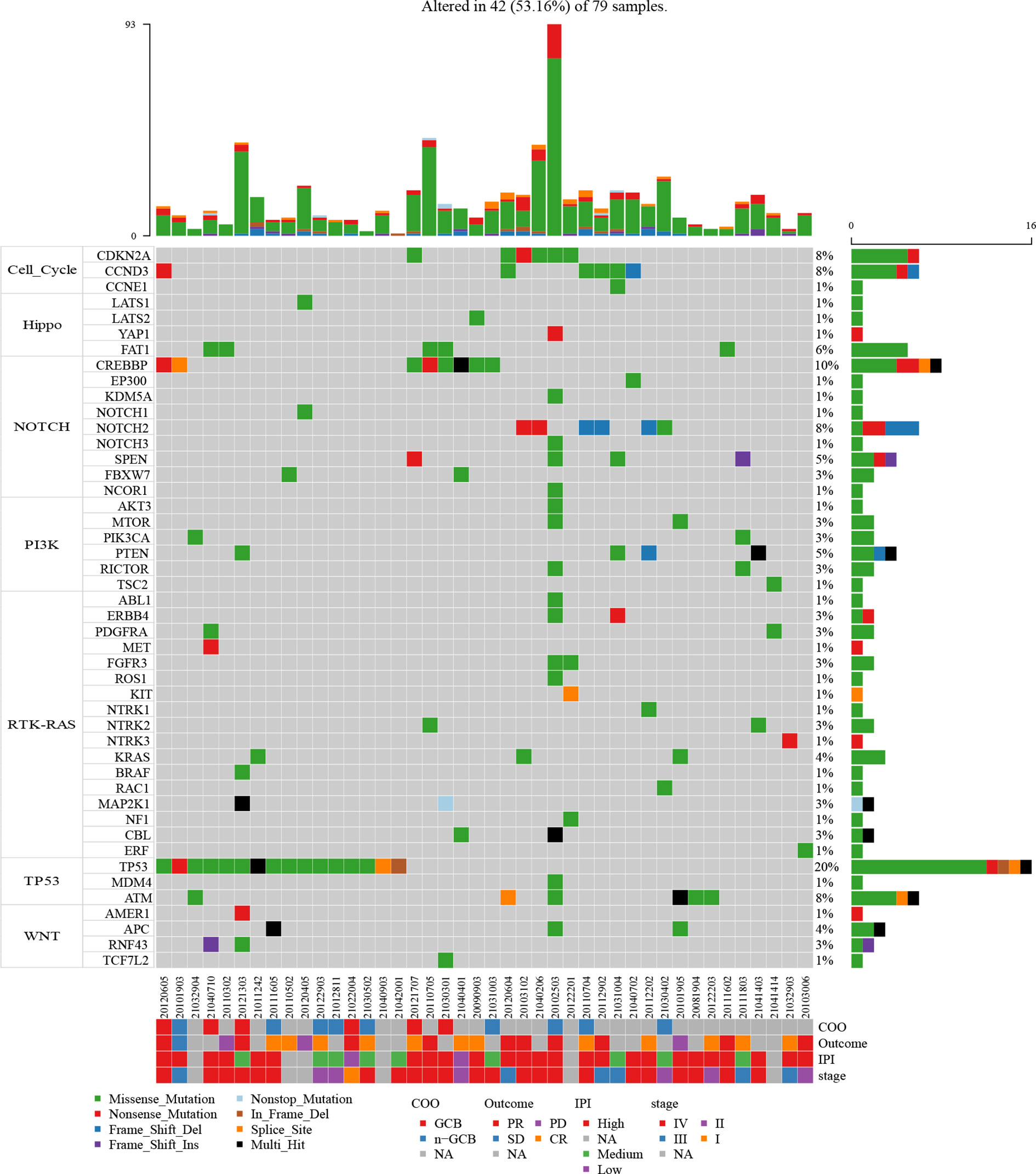
图 1. 79 例 B 细胞淋巴瘤患者的 7 种典型致癌信号通路的突变图。不同颜色编码表示突变类型。Y 轴显示至少在特定基因中有 1 个突变的患者百分比。
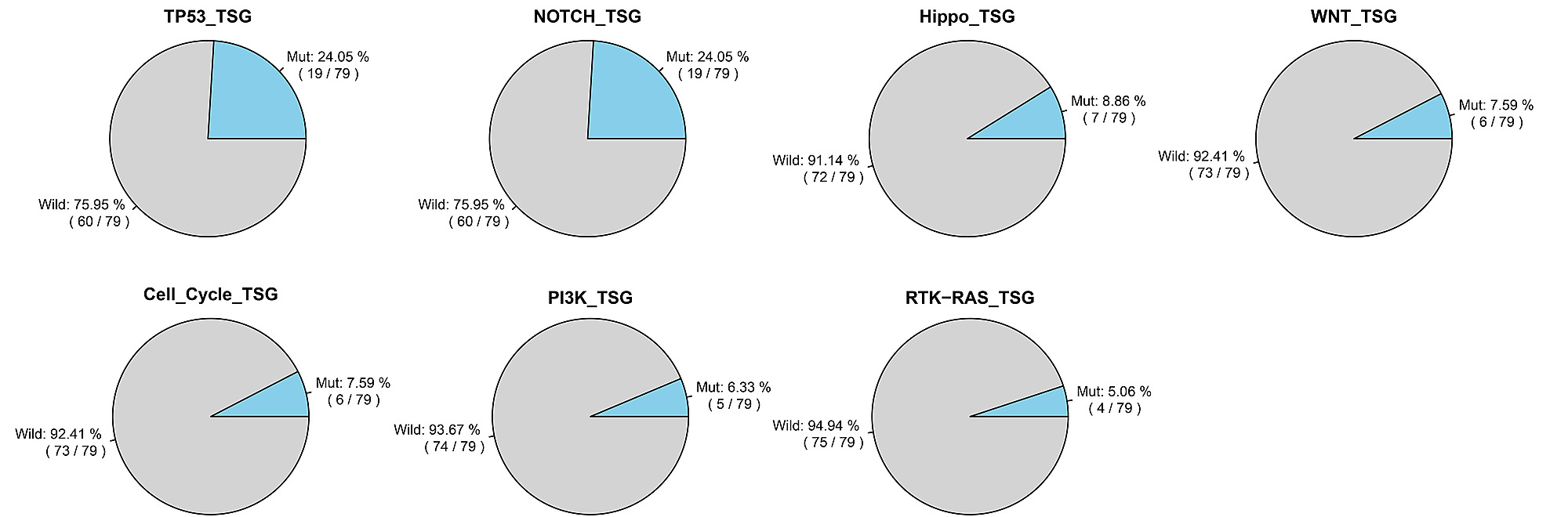
图 2. 79 例 B 细胞淋巴瘤患者的 7 种典型致癌信号通路的突变率。
3.3 融合基因、突变基因和通路的预后作用
为进一步调查融合基因、常见突变基因 Top 30 以及 7 种典型致癌通路在基因组异常组中的临床影响,研究评估了这些基因组变异与 52 例完整数据患者的无进展生存期 (PFS) 之间关联。结果显示,在 5 个融合基因中,只有携带 SEPT6_TRIM33 融合基因的患者 PFS 显著较短 (P < 0.0001,图 3. A)。此外,携带这 5 个融合基因中任何一个的患者显示出不良预后的趋势 (P = 0.034,图 3. B)。在具有突变的 TP53 基因 (P = 0.0086,图 3. C)、突变的 TP53 通路 (P = 0.013,图 3D)和突变的 Hippo 通路 (P
= 0.0038,图 3. E) 的 B 细胞淋巴瘤患者 (N = 52) 中也观察到不良预后。在其他常见突变基因或通路的突变与否,PFS 没有显著差异。
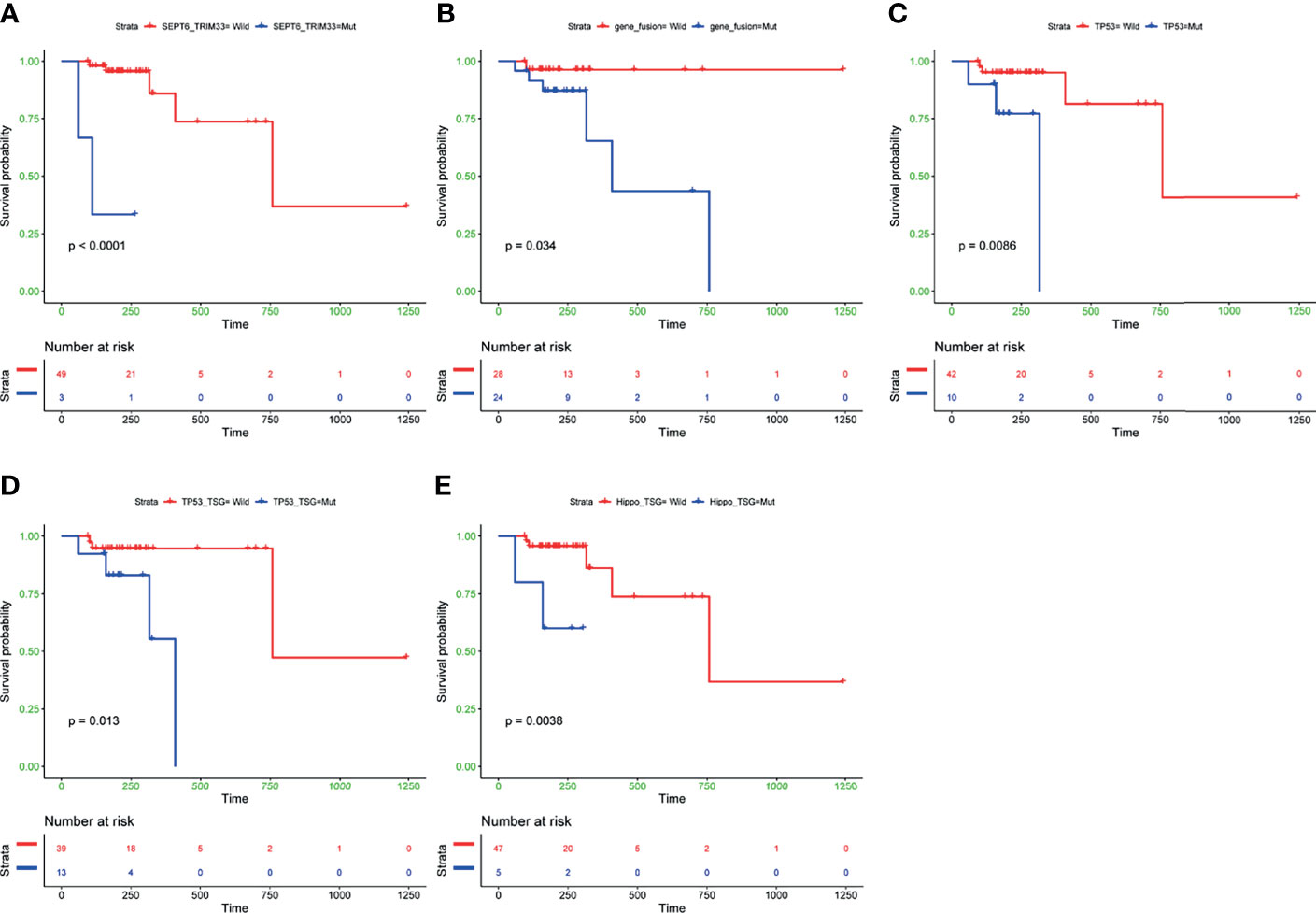
图 3. 不同亚组之间 PFS 差异的 Kaplan-Meier 曲线。A. SEPT6_TRIM33 基因融合亚组;B. 至少在 2 例患者中检测到的 5 个融合基因中的任何一个的亚组;C. TP53 基因突变亚组;D. 突变的 TP53 通路亚组;E. 突变的 Hippo 通路亚组。
3.4 TP53 和 Hippo 通路中突变基因的 VAFs 变化
以上研究结果表明,突变的 TP53 和 Hippo 通路与患者预后显著相关,为了评估这两个通路中基因的状态在化疗后是否会改变,研究分析了 18 例 B 细胞淋巴瘤患者的配对基线和治疗后样本中 TP53 和 Hippo 通路中基因的等位基因频率 (VAF)。如图 4. 所示,Pt18 (DLBCL 亚型) 在接受四个周期的 R-DA-EDOCH 治疗后达到 PR,TP53 p.Y87N 突变的 VAF 增加 (TP53 通路;0 vs. 17.86%),而 FAT1 p.E1292K 突变的 VAF 降低 (Hippo 通路;44.74 vs. 0%),这可能是对 R-DA-EDOC 的部分敏感性或获得性耐药性的原因。有趣的是,2 例 CR 患者分别检测到 TP53 p.Y88C (Pt42,DLBCL 亚型,R-miniCHOP 治疗五个周期) 和 LATS2 p.F972L (Pt5,FL 亚型,R-COEP 治疗四个周期) 的 VAF 降低。这些结果表明,TP53 和 Hippo 通路中突变基因的 VAF 变化可能是治疗反应的指标。
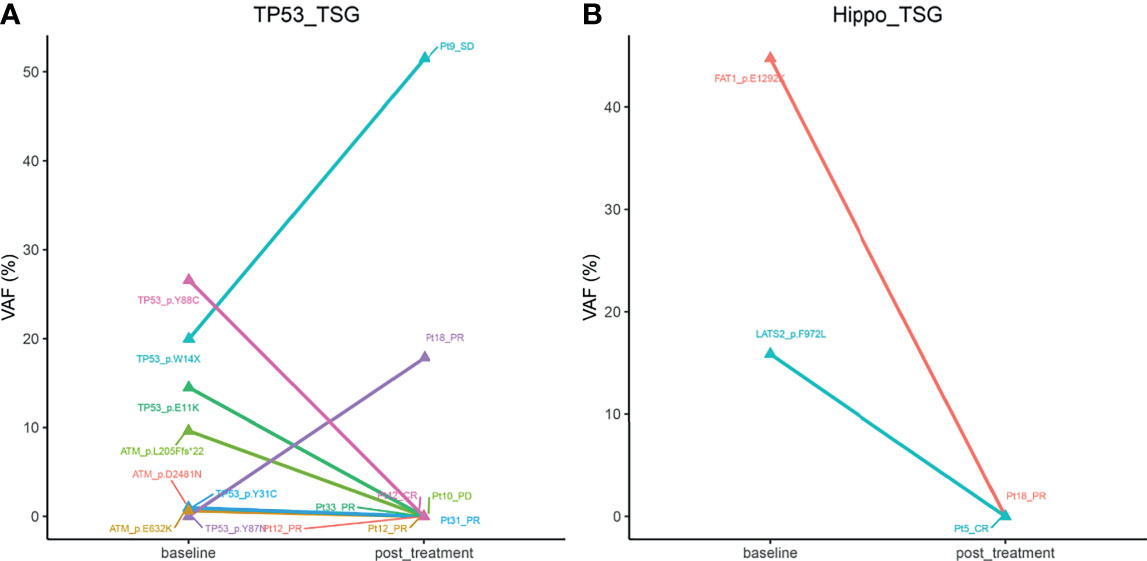
图 4. 来自 18 例 B 细胞淋巴瘤患者的配对基线和治疗后样本中突变基因的平均 VAF 的变化。A. Tp53 通路;B. Hippo 通路。
3.5 基因组异常与治疗反应的相关性
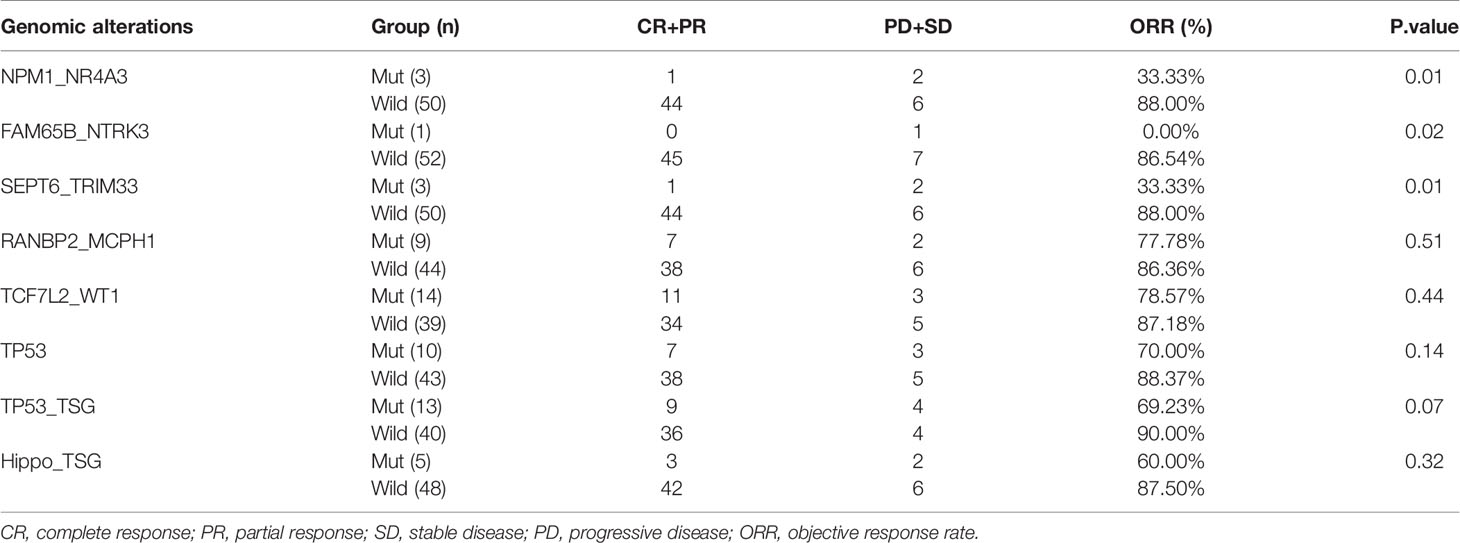
为了探究融合基因、突变基因以及通路与治疗反应之间的关系,研究比较了具有特定基因组异常和没有特定基因组异常的患者之间的 ORR。结果显示,具有 NPM1_NR4A3 (33.33 vs.88%,P = 0.01) 和 SEPT6_TRIM33 (33.33 vs 88%,P = 0.001) 融合基因的患者与没有相应融合基因的患者之间的 ORR 存在显著差异 (表 2.)。虽然其他融合基因、TP53 基因突变 (70 vs. 88.37%,P = 0.14)、突变的 TP53 (69 vs. 90%,P = 0.07) 和 Hippo 通路 (60 vs. 87.5%,P = 0.33) 的患者的 ORR 趋向较低,但在统计学上没有显著差异。
表 2. 基因组异常与临床治疗反应之间的关系
04 总结
本研究综合分析了 B 细胞淋巴瘤的分子特征,并发现 SEPT6_TRIM33 融合基因、单一 TP53 基因的突变、突变的 TP53 以及 Hippo 通路共同预测 B 细胞淋巴瘤的不良预后。该研究可能提供了具有预后意义和潜在治疗靶点的新型基因组生物标志物,为 B 细胞淋巴瘤的治疗提供了新的方向。识别与耐药性和不良预后相关的 TP53 和 Hippo 通路的异常,以及新的基因融合,并针对这些突变进行药物干预,从而提高 B 细胞淋巴瘤患者的生存率。
产品推荐

参考文献
[1]. Copie-Bergman C, Cuillière-Dartigues
P, Baia M, Briere J, Delarue R, Canioni D, et al. MYC-IG Rearrangements Are
Negative Predictors of Survival in DLBCL Patients Treated With
Immunochemotherapy: A GELA/LYSA Study.Blood (2015) 126(22):2466–74. doi:
10.1182/blood-2015-05-647602
[2]. Rosenwald A, Bens S, Advani R, Barrans
S, Copie-Bergman C, Elsensohn MH, et al. Prognostic Significance of MYC
Rearrangement and Translocation Partner in Diffuse Large B-Cell Lymphoma: A
Study by the Lunenburg
Lymphoma Biomarker Consortium. J Clin Oncol
(2019) 37(35):3359–68.doi: 10.1200/jco.19.00743
[3]. Juskevicius D, Jucker D, Klingbiel D,
Mamot C, Dirnhofer S, Tzankov. a. Mutations of CREBBP and SOCS1 Are Independent
Prognostic Factors in Diffuse Large B Cell Lymphoma: Mutational Analysis of the
SAKK 38/07 Prospective Clinical Trial Cohort. J Hematol Oncol (2017)
10(1):1–10. doi: 10.1186/s13045-017-0438-7
[4]. Mansouri L, Noerenberg D, Young E,
Mylonas E, Abdulla M, Frick M, et al. Frequent NFKBIE Deletions Are Associated
With Poor Outcome in Primary Mediastinal B-Cell Lymphoma. Blood (2016)
128(23):2666–70. doi: 10.1182/blood-2016-03-704528
[5]. Ferrero S, Rossi D, Rinaldi A,
Bruscaggin A, Spina V, Eskelund CW, et al. KMT2D Mutations and TP53 Disruptions
Are Poor Prognostic Biomarkers in Mantle Cell Lymphoma Receiving High-Dose
Therapy: A FIL Study. Haematologica (2020) 105(6):1604–12. doi: 10.3324/haematol.2018.214056
[6]. Lindqvist CM, Nordlund J, Ekman D, Johansson A, Moghadam BT, Raine A, et al. The Mutational Landscape in Pediatric Acute Lymphoblastic Leukemia Deciphered by Whole Genome Sequencing. Hum Mutat (2015) 36(1):118–28. doi: 10.1002/humu.22719








