三代靶向药耐药后怎么办?这项研究有望为晚期肺癌治疗带来新希望
新知小课堂
Q1 肺癌患者有必要做基因检测吗?
随着精准医疗的发展,基因检测已成为制定个体化治疗方案的关键环节。通过检测肿瘤驱动基因突变,医生能够为患者选择最匹配的靶向药物,显著提升治疗效果。更重要的是,对于靶向治疗过程中出现的耐药问题,基因检测能够帮助明确耐药机制,为后续治疗方案的调整提供科学依据。研究表明,约 60% 的靶向治疗失败与获得性耐药突变相关,这使得基因检测在肺癌全程管理中显得尤为重要。
Q2 什么是 ALK 酪氨酸激酶抑制剂?
ALK 酪氨酸激酶抑制剂 (ALK-TKIs) 是一类针对间变性淋巴瘤激酶 (ALK) 基因突变肿瘤的靶向治疗药物,通过抑制 ALK 融合蛋白的异常激活,阻断下游致癌信号,从而抑制肿瘤生长和扩散。
01 背景
我国肺癌形势严峻,据国家癌症中心统计数据显示,肺癌在中国恶性肿瘤死亡构成比中高达 23.8%,其发病率和死亡率均位居各类癌症前列。其中,ALK 阳性肺癌作为一种特殊亚型,好发于相对年轻人群 (中位年龄 50 岁),且多见于不吸烟或轻度吸烟者,约占非小细胞肺癌 (NSCLC) 患者的 3%-5%。这类患者对 ALK-TKIs 初始治疗反应良好。但临床面临的主要挑战是耐药问题——无论是第一代 (如克唑替尼) 还是第二代 (如阿来替尼) 药物,最终都难以避免耐药发生,这一现象让众多患者陷入“靶向治疗失败”的困境。尽管第三代药物洛拉替尼能有效克服多数一、二代耐药突变,但临床观察发现,部分患者仍会因 ALK 复合突变或非 ALK 通路异常而出现耐药。
2023 年 5 月 16 日,中国人民解放军总医院第五医学中心肿瘤高级科在 Thoracic Cancer (IF=3.2) 期刊上发表了题为“Dynamic monitoring of circulating tumor DNA to analyze genetic characteristics and resistance profile of lorlatinib in ALK positive previously treated NSCLC”的研究性论文[1]。该研究结合临床工作,观察了三代靶向药洛拉替尼对一代和二代 ALK-TKIs 耐药的 ALK 阳性晚期 NSCLC 患者的疗效和安全性,并通过靶向 ctDNA 测序分析了洛拉替尼治疗前后的基因特征动态变化,旨在为多种 ALK-TKIs 耐药后的进一步治疗提供指导基础。本研究中的文库构建和杂交捕获实验基于纳昂达高性能靶向测序技术方案完成,为后续检测分析提供了关键技术支撑。
02 研究方法
2.1 样本来源
10 例 ALK 阳性晚期 NSCLC 患者 (均对一/二代 ALK-TKIs 耐药),既往接受洛拉替尼治疗至少 42 天。在洛拉替尼治疗前、治疗期间及疾病进展时共采集 38 份外周血样本。
2.2 文库制备与靶向测序
分别从患者的血浆和血液淋巴细胞中提取 ctDNA 和 gDNA,使用 NadPrep® DNA Library Preparation Kit 构建文库,搭配 NadPrep® Hybrid Capture Reagents 进行目标区域富集。捕获后的文库在 Novaseq 6000 平台进行双端测序。
2.3 数据处理
使用 Fastp (version 0.20.0) 和 BWA (Version: 0.7.12-r1039) 进行数据过滤与比对,通过 vardict-java (version 1.7.0–0) 和 GATK4 中的 Mutect2 (version4.1.8.1) 检测 SNVs 和 Indels,factera (version 1.4.4) 检测结构变异。过滤后,这些变异通过 VEP (version 104) 进行注释。
03 研究结果
3.1 患者特征
【基本情况】10 例接受过一/二代 ALK-TKIs 治疗后进展的 ALK 阳性晚期 NSCLC 患者;
【基线特征】中位年龄 50 岁 (27-69岁);
【组织学】9 例腺癌 (90%),1 例腺鳞癌 (10%);
【既往治疗】5 例仅接受过克唑替尼治疗,5 例接受过双线 ALK-TKIs 治疗。
表 1. 洛拉替尼治疗患者的临床和分子特征
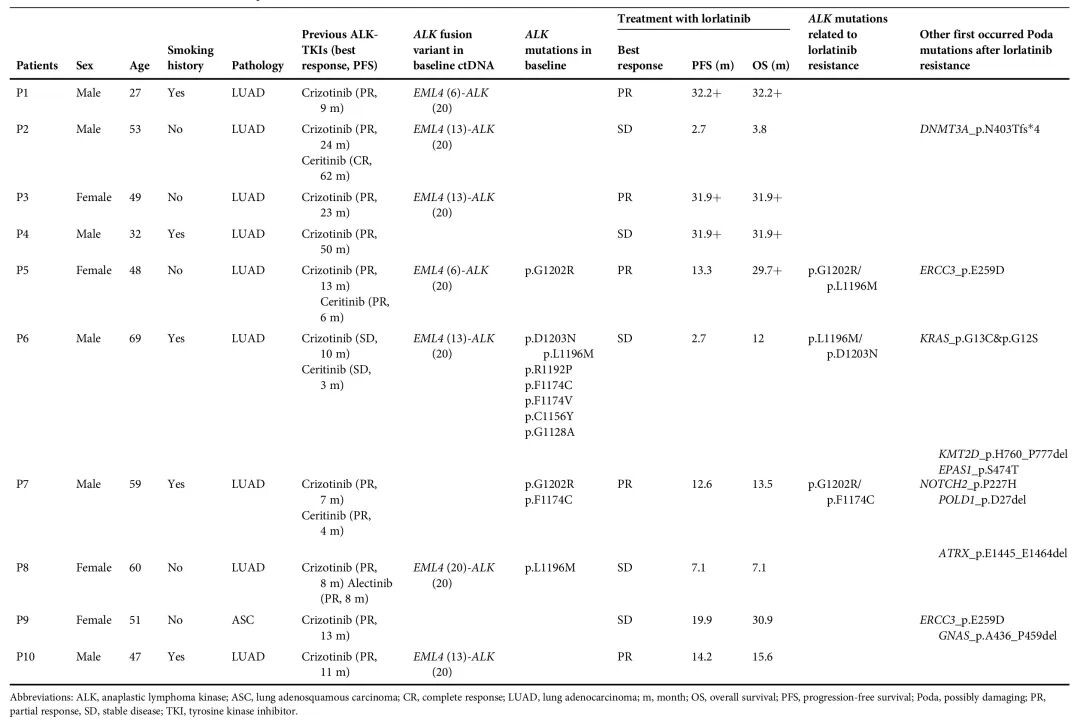
3.2 洛拉替尼治疗前 ctDNA 的基因变异分析
靶向测序结果显示,从 10 例接受洛拉替尼治疗的患者 ctDNA 中检测到 68 个变异 (涉及 43 个基因),其中 28 个为驱动基因 (图 1. a)。在既往接受过洛拉替尼治疗的患者中,大多数变异类型为错义突变 (图 1. a),C>T 和 T>C 为最常见 SNV (图 1. b),高频突变基因包括 KMT2C (6/10)、TP53 (5/10)、ALK (4/10)、NOTCH2 (3/10) 和 FOXL2 (3/10) (图 1. c)。接受过双线 ALK-TKIs 治疗的患者中,ALK (80% vs. 0%) 和 TP53 (80% vs. 20%) 突变频率显著高于仅接受克唑替尼治疗的患者 (图 1. d)。
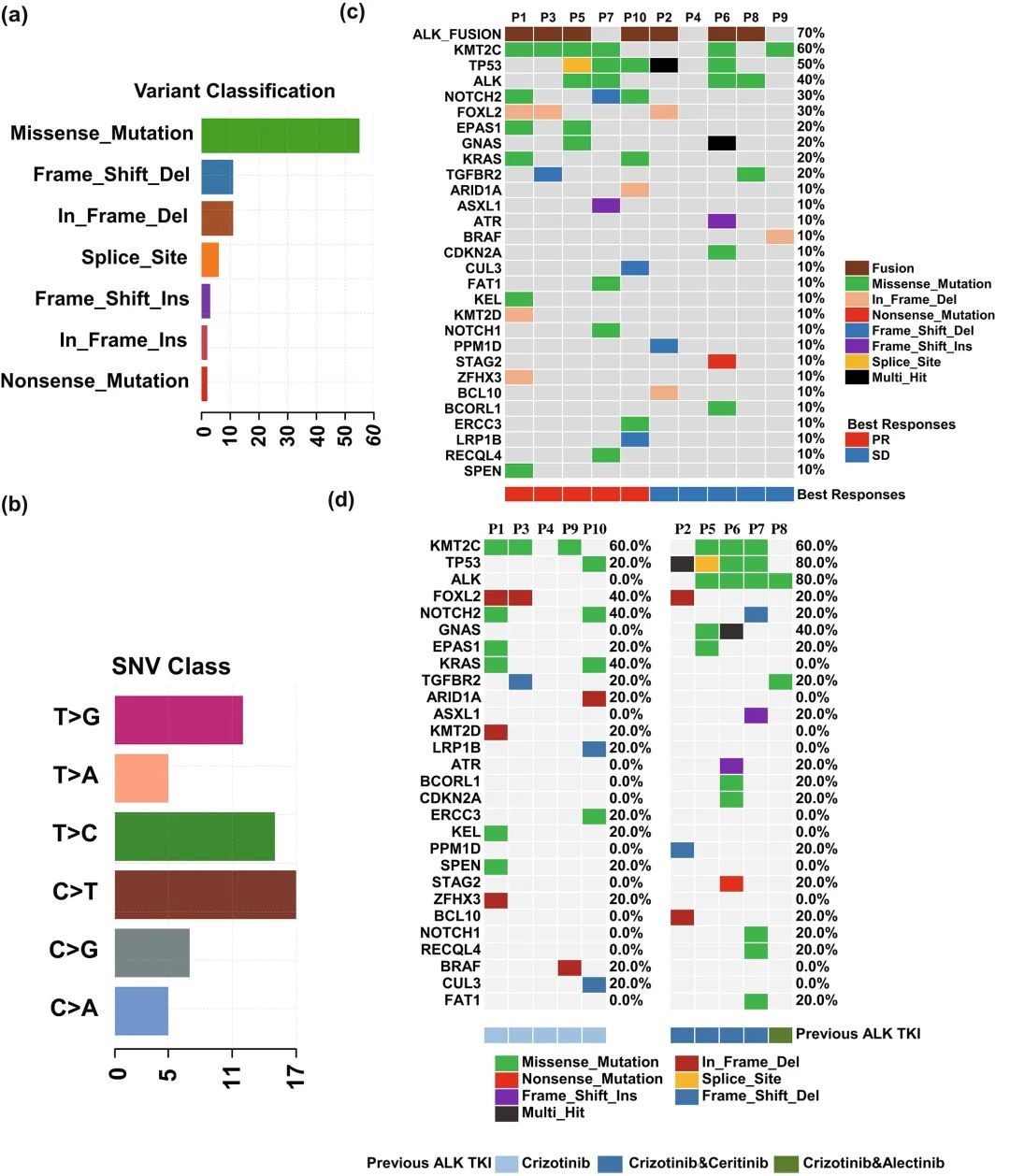
图 1. 10 例患者在洛拉替尼治疗前基线 ctDNA 的基因突变图谱和模式。 (a)-(b) 10 例样本的突变类型 (a) 和 SNV 类型 (b) ;(c) 10 例患者在洛拉替尼治疗前基线 ctDNA 的驱动基因突变情况;(d) 在既往使用不同 ALK-TKIs 治疗的患者中,基线 ctDNA 的基因突变情况。
注:不同颜色代表不同突变。PR,部分缓解;SD,疾病稳定。
3.3 洛拉替尼治疗期间 ctDNA 的动态变化
除基线外,在洛拉替尼治疗期间还进行了一系列 ctDNA 检测 (图 2.),结果显示在首个随访周期 (T1),6 例患者 ctDNA 突变等位基因频率 (VAF) 较基线下降 (其中 4 例 PR,2 例 SD),另外 4 例患者 VAF 较基线未降低 (其中 1 例 PR,3 例 SD) (图 3. a)。平均 VAF 降低最多的 3 例患者疗效评价最佳,为 PR (图 3. b)。
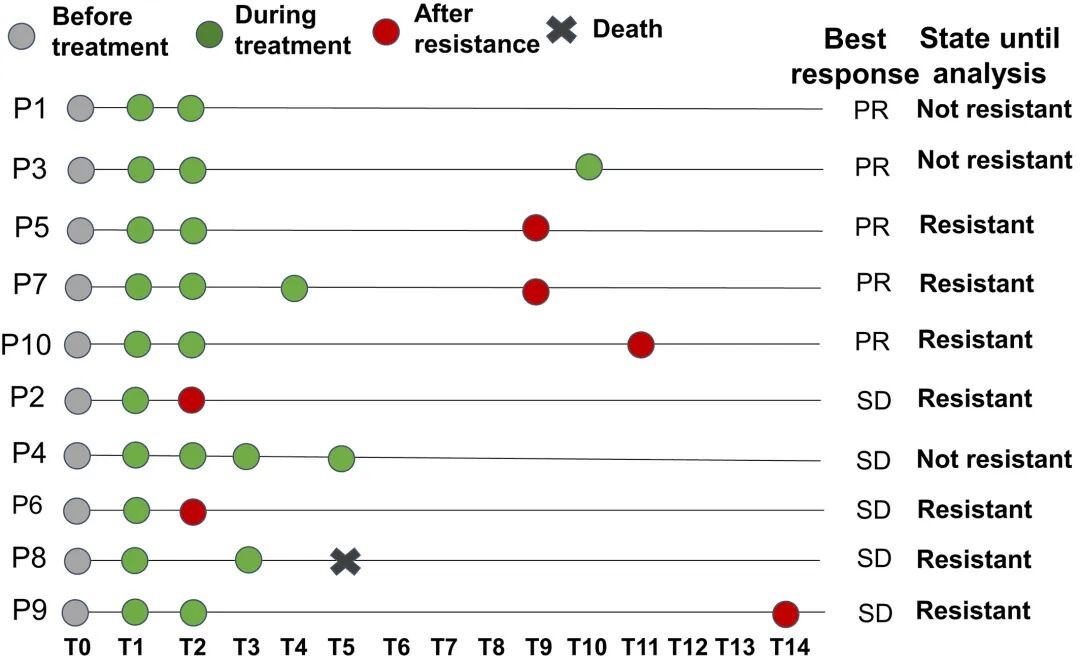
图 2. 每个患者的 ctDNA 检测时间线。
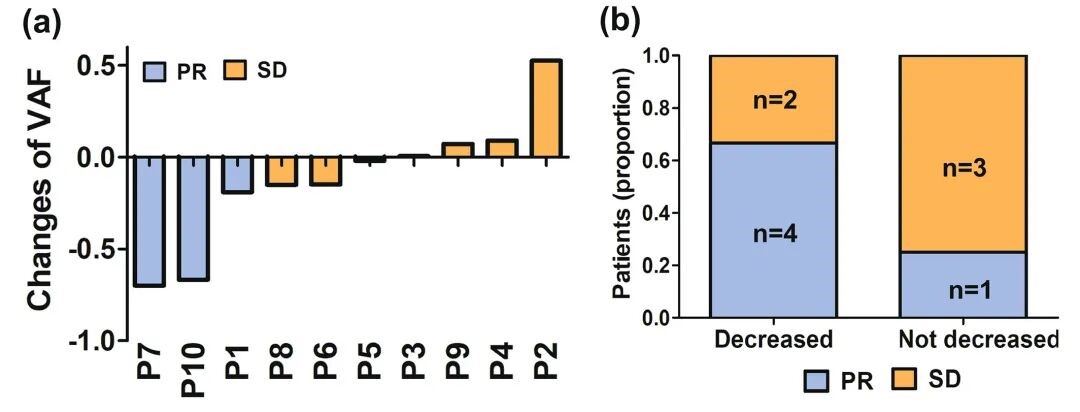
图 3. 洛拉替尼治疗开始后 T1 ctDNA 水平的变化。(a) 每例患者的平均 VAF 和最佳反应的变化。(b) T1 中 ctDNA VAF 降低与肿瘤反应之间的关系。
3.4 洛拉替尼耐药患者 ctDNA 变异检测
在最后一次随访时,7 例患者出现疾病进展。对其中 6 例进展期患者采集血液,通过分析 ctDNA 中的耐药突变发现 (图 4.),有 3 例患者在接受洛拉替尼治疗后检测出 ALK 复合突变 (3/6 例):
P5 患者:G1202R/L1196M 复合突变 (基线未检出)。
P6 患者:L1196M/D1203N 复合突变 (基线 VAF 为 0.6%,进展后升至 9.1%),同时伴随 KRASG13C/G12S、KMT2DH760-P777del 等新发突变。
P7 患者:基线携带 G1202R/F1174C 复合突变 (VAF 0.3%),进展后仅 G1202R 复发 (VAF 0.6%)。
另外 3 例患者检测出非 ALK 复合突变 (3/6 例):
P2 患者:进展后首次检出 DNMT3AN403Tfs*4 (表观遗传调控基因)。
P9 患者:检出 ERCC3 E259D (DNA 修复基因) 和 GNAS p.A436_P459del (癌基因)。
P10 患者:TP53 突变 (E271K) 频率从基线 0.7% 升至 6.3%。
这揭示了洛拉替尼耐药机制的多样性。

图 4. 在洛拉替尼耐药患者中检测到的基因变异。(a)-(f) 在每个洛拉替尼耐药患者中检测到的 ALK 基因突变和其他驱动基因可能的破坏性突变。
注:PD,疾病进展。
04 总结与展望
本研究通过动态监测洛拉替尼治疗期间 NSCLC 患者 ctDNA 的基因组特征变化,揭示了中国 ALK 阳性患者对洛拉替尼耐药的突变图谱。研究发现,50% 的洛拉替尼耐药患者存在 ALK 复合突变,这一发现不仅证实了洛拉替尼耐药机制的异质性特征,更为中国 ALK 阳性 NSCLC 患者的后续精准治疗策略制定提供了重要的分子生物学依据。
参考文献
[1] Ma X, Zhang K, Xu J, et al. Dynamic monitoring of circulating tumor DNA to analyze genetic characteristics and resistance profile of lorlatinib in ALK positive previously treated NSCLC[J]. Thoracic Cancer, 2023, 14(20): 1980-1990.








